剛剛,第十一批國采正式文件發布
倒計時一個月,第十一批國采即將開標。
01
55個大品種被納入
下個月21號開標
9月20日,國家醫保局發布第十一批國采正式文件,55個大品種的市場爭奪戰拉開序幕。
第十一批國采自10月21日(星期二)上午7點30分開始接收申報材料,遞交截止時間為當日上午10點30分,地點為上海市青浦區竹盈路340弄1號;申報時間和地點同上。

此次被納入采購品種范圍的藥品需要于9月28日(含)前獲得國內有效注冊批件,并須在“國家醫保服務平臺”(fuwu.nhsa.gov.cn)按照“六、基礎信息填報截止時間”的要求填報藥品信息。
符合申報資格的企業和品種須在9月28日24點前在“國家醫保服務平臺”(fuwu.nhsa.gov.cn)完成企業和藥品相關信息首次填報并提交,24點后不再受理首次填報提交的藥品信息。如首次填報信息經審核后需修改或補充材料的,須于9月29日16點前再次提交。
此次集采的品種規模與競爭強度備受行業關注。江蘇華招網數據顯示,以上市許可持有人為統計維度,此次被納入國采的55個品種競爭企業均≥7家,多數品種呈現十余家企業同臺競技的格局,市場競爭已進入白熱化階段。
第十一批國采的報量基礎工作已于8月完成。根據國家醫保局披露的數據,本次報量覆蓋全國46359家醫藥機構,醫療機構的報量有77%具體到廠牌,23%按通用名報量。55個品種中,有25個品種有參比制劑參加,報量份額約為30%。
同日,國家組織藥品聯合采購辦公室發布《關于開展第十一批國家組織藥品集中采購投標企業報名工作的通知》。
自今日起,國家醫保服務平臺(fuwu.nhsa.gov.cn)面向企業開放報名通道。持有填報范圍內藥品參比制劑或通過質量和療效一致性評價仿制藥注冊證的上市許可持有人或生產企業均可參加(境外上市許可持有人由境內責任人(境內代理人)填報)。

在約定采購量確定規則上,本次集采延續歷次成熟框架,同時針對特殊品種作出差異化調整。聯采辦明確,一般以醫療機構報量的80%作為約定采購量,對于中選企業數3家及以下的品種適當降低帶量比例。
在此基礎上,采納部門及專家意見,對糖皮質激素類藥物、抗菌藥物、限適應癥報量的品種、重點監控藥品等,帶量比例適當降低10-20個百分點,降至60-70%。
02
三個規則
確定擬中選
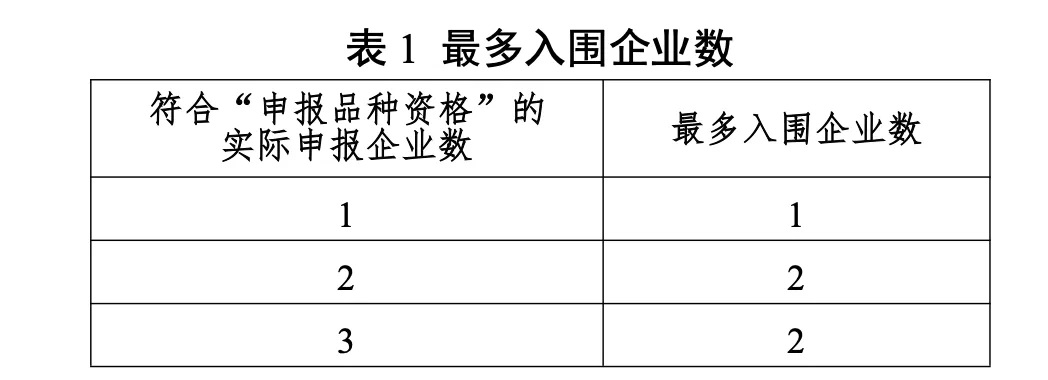
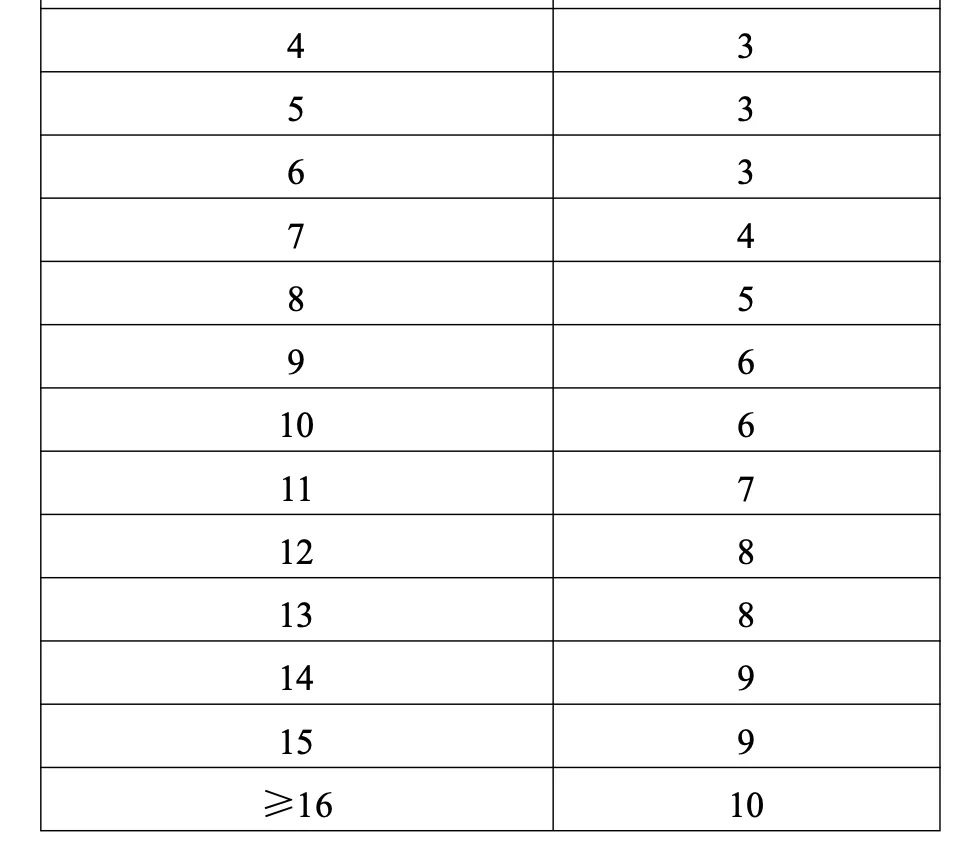
同品種入圍企業根據最多入圍企業數及申報企業順位確定,符合“申報品種資格”的實際申報企業數≥16家時,最多入圍企業數為10家。
以采購品種范圍內同品種主流規格(即全國首年機構需求量(按含量折算)最大的規格)作為代表規格,參照藥品差比價規則折算至最小計量單位后的價格作為“單位可比價”。按“單位可比價”由低到高確定申報企業順位。“單位可比價”最低的為第一順位,次低的為第二順位,依次類推確定其他順位。
同品種申報企業“單位可比價”相同時,首先看企業有無被任意一省依據醫藥價格和招采信用評價制度評定為“嚴重失信”或“特別嚴重失信”,若無則優先。其次還有全國首年機構需求量(按含量折算)、國家藥品監督管理部門發布的仿制藥質量和療效一致性評價參比制劑等條件。
擬中選企業的確定共有三個規則,依次如下:
規則一:直接中選,價格達標即可獲資格。有效申報入圍企業滿足以下任一價格條件,直接獲得擬中選資格:
1、比價達標。“單位可比價”≤同品種 “錨點價格” 的1.8倍。錨點價格為 “有效申報入圍企業單位可比價平均值的50%” 與 “最低單位可比價” 中的較高值;若實際申報企業僅1家或2家,需滿足 “單位申報價較最高有效申報價的降幅≥其他擬中選品種平均降幅的50%”。
2、低價兜底。按劑型劃分的低價門檻達標,口服固體制劑(含泡騰片)“單位可比價”≤0.1元、小容量注射劑≤1元、大容量注射液≤2元。
規則二:跟標中選,接受達標價格可補錄。按規則一未獲中選資格的有效申報入圍企業,滿足以下條件可獲擬中選資格:
1、常規跟標。接受 “規則一確定的同品種最高擬中選價格”;若規則一僅1家擬中選企業,接受 “錨點價格的1.8倍”。
2、少數企業特殊跟標。若同品種實際申報僅1家或2家,且未通過規則一,接受 “單位申報價較最高有效申報價的降幅≥其他擬中選品種平均降幅的50%”,視同按規則二擬中選。
規則三:遞補中選,未入圍但需求達標可申請。有效申報但未入圍的企業,同時滿足以下3個條件,可獲擬中選資格(按擬中選價格分配一定比例首年機構需求量):
1、本廠牌首年機構需求量≥同品種各廠牌首年需求量平均值(關聯企業計為1家廠牌,聯合體需求量合并計算);
2、非同品種最高順位;
3、接受以下任一價格,包括不高于規則一、二確定的同品種最高擬中選價格;不高于 “規則一、二最高擬中選價格與錨點價格的平均值”;不高于錨點價格。
對于供應,核心規則是按照歸責和規則二確定的擬中選企業從第一順位開始,按順位依次選擇供應地區,每輪僅能選擇1個地區;完成首輪選擇后重復該過程,直至所有地區均被選定。
值得注意的是,各品種各地采購周期自中選結果執行之日起至2028年12月31日。
03
規則優化
反內卷、防圍標、穩臨床、保質量...
對比第十批國采正式文件,此次國采在申報企業要求、報量、規則方面都做出了優化。
一、從價格形成、價差控制、成本核驗三個維度構建“反內卷”防線,避免藥企之間低價廝殺。
早在此次國采開展之前,國家醫保局已經明確集采“反內卷”。在最高有效申報價測算上,第十一批國采剔除省級集采中“獨家中選”產生的異常低價,避免個別極端價格拉低整體定價基準,防范大幅漲價中選與過度壓價入圍的雙重風險。
價差控制規則的優化更具針對性,不再簡單以最低價為價差控制錨點,設置異常低價熔斷機制,當企業報價低于“入圍均價的50%”時,自動以“入圍均價的50%”為價差控制基準。
根據專家對第7-10批集采200余個品種的報價情況進行的模擬測算,在最高報價與最低報價大于1.8倍個品種中,如按現有規則,有1/4左右的品種觸發調高“錨點”,相對于最低報價,平均調高34%,最大調高170%。
同時,第十一批國采要求每家投標企業做出不低于成本報價的承諾,對于低于“錨點價”的企業,需詳細說明制造成本、期間費用、銷售利潤等構成。
二、從約束、激勵、懲戒三方面出發,組合出臺配套措施防圍標。
在主體認定上,第十一批國采明確將股權、管理、注冊批件轉讓、委托生產等存在緊密關聯的企業視為關聯主體,投標時視為1家,從源頭壓縮圍標操作空間;創新引入“首告從寬”機制,對于首個提供圍標線索及有效證據的企業,以及圍標事件調查過程中首個主動承認參與圍標的企業,可依法依規從寬處理。
與此同時,懲戒力度進一步升級,圍標串標企業不僅將被列入集采“違規名單”,還將依據醫藥價格和招采信用評價制度予以頂格處置,信用懲戒結果直接與后續招采資格掛鉤。
三、報量模式變化:醫療機構采取通用名+具體品牌的雙軌報量模式。
第十一批集采首次允許醫療機構采取通用名+具體品牌的雙軌報量模式,醫療機構報量的品牌若成功中選,將直接成為該機構的指定供應企業,從機制上提升供需匹配效率。
在約定采購量上,第十一批國采將醫療機構報量的60%-80%作為競爭標的,剩余份額保留醫療機構自主選擇權。對于臨床需求規模大但報價未入圍的企業,第十一批國采采取價格跟隨的方式,即如果企業接受中選價格,可“復活”獲得中選資格,避免因報價偏差導致臨床常用品牌缺位。
四、設置藥企資質三重質量門檻,藥監部門將對本次中選產品實施檢查與抽檢“兩個全覆蓋”全鏈條管控形成閉環。
在藥品質量上,第十一批國采提出了更高的要求。在企業資質審核環節設置三重質量門檻:
一是要求投標企業或其委托生產企業具備2年以上同類劑型生產經驗,且生產線通過藥品GMP符合性檢查;二是將生產質量考察范圍從“投標藥品”擴展至“投標藥品的生產線”,要求生產線2年內無違反GMP記錄;三是建立“質量優先”的中選排序規則,即報價相同時,醫療機構報量更高、未發生生產工藝及原料藥輔料重大變更的企業優先中選。
值得注意的是,本次國采進一步強化中選結果的全鏈條執行監管,有關問題經核實后,醫保部門將按標書、采購合同及相關政策規定快速處置。
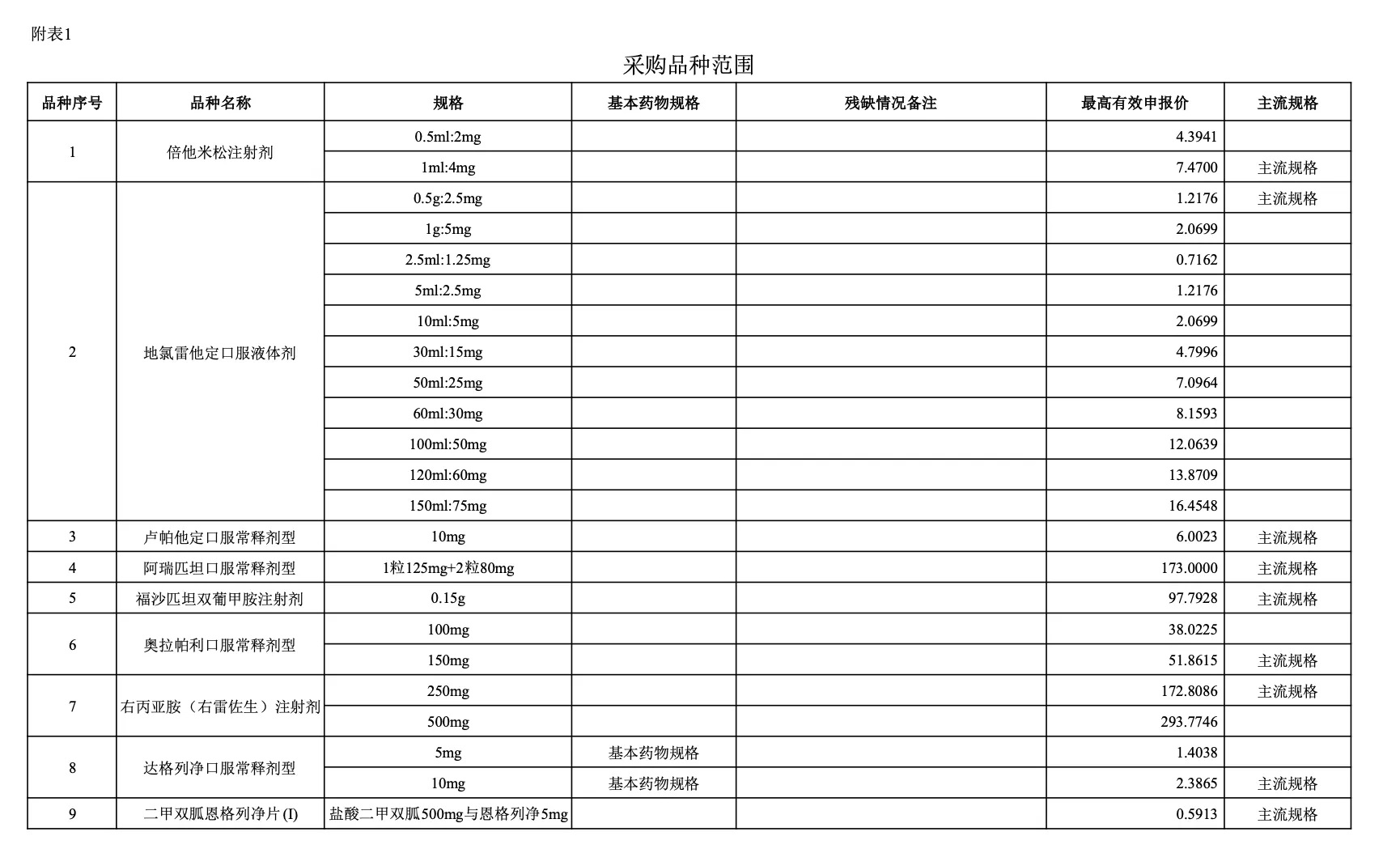
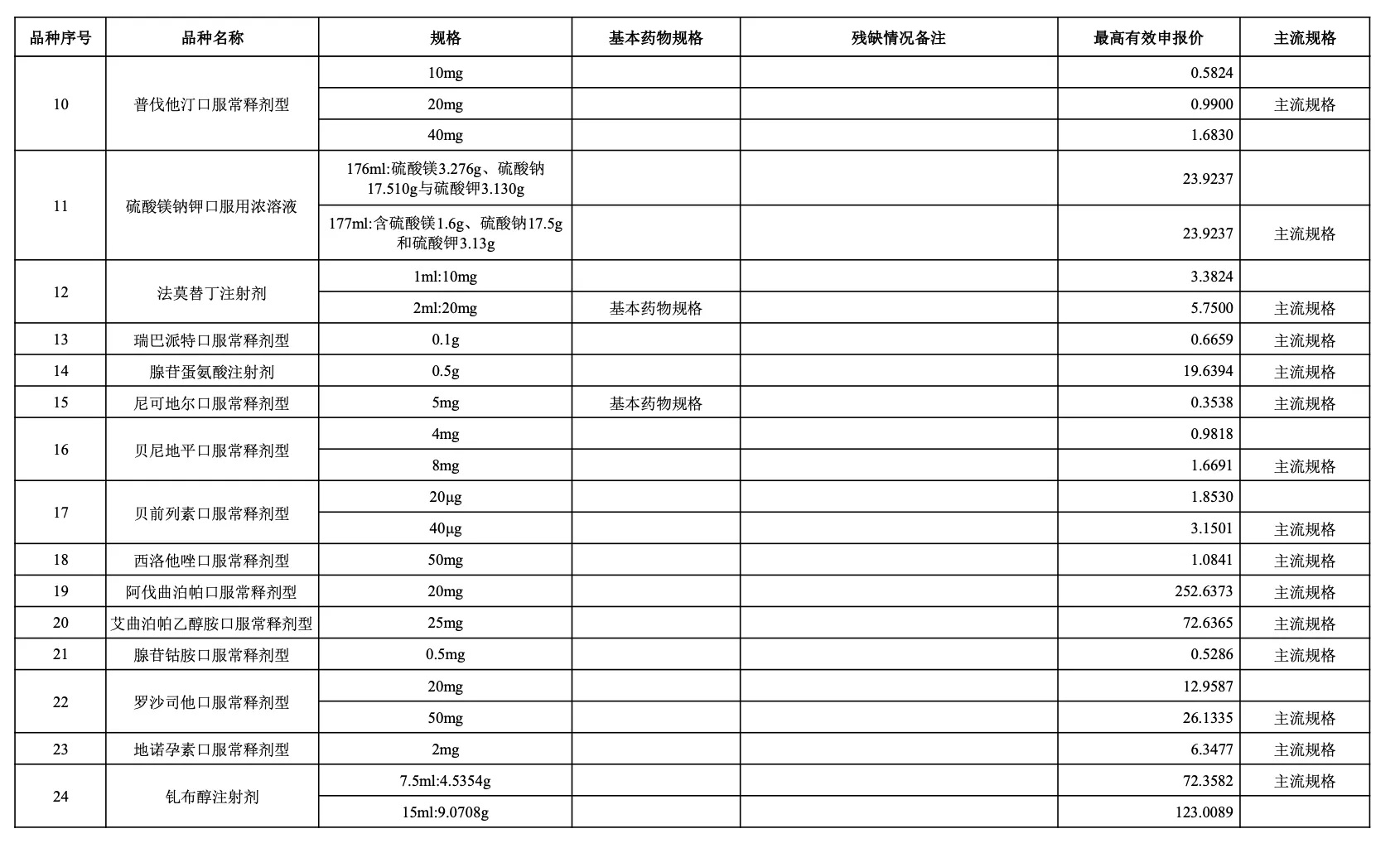
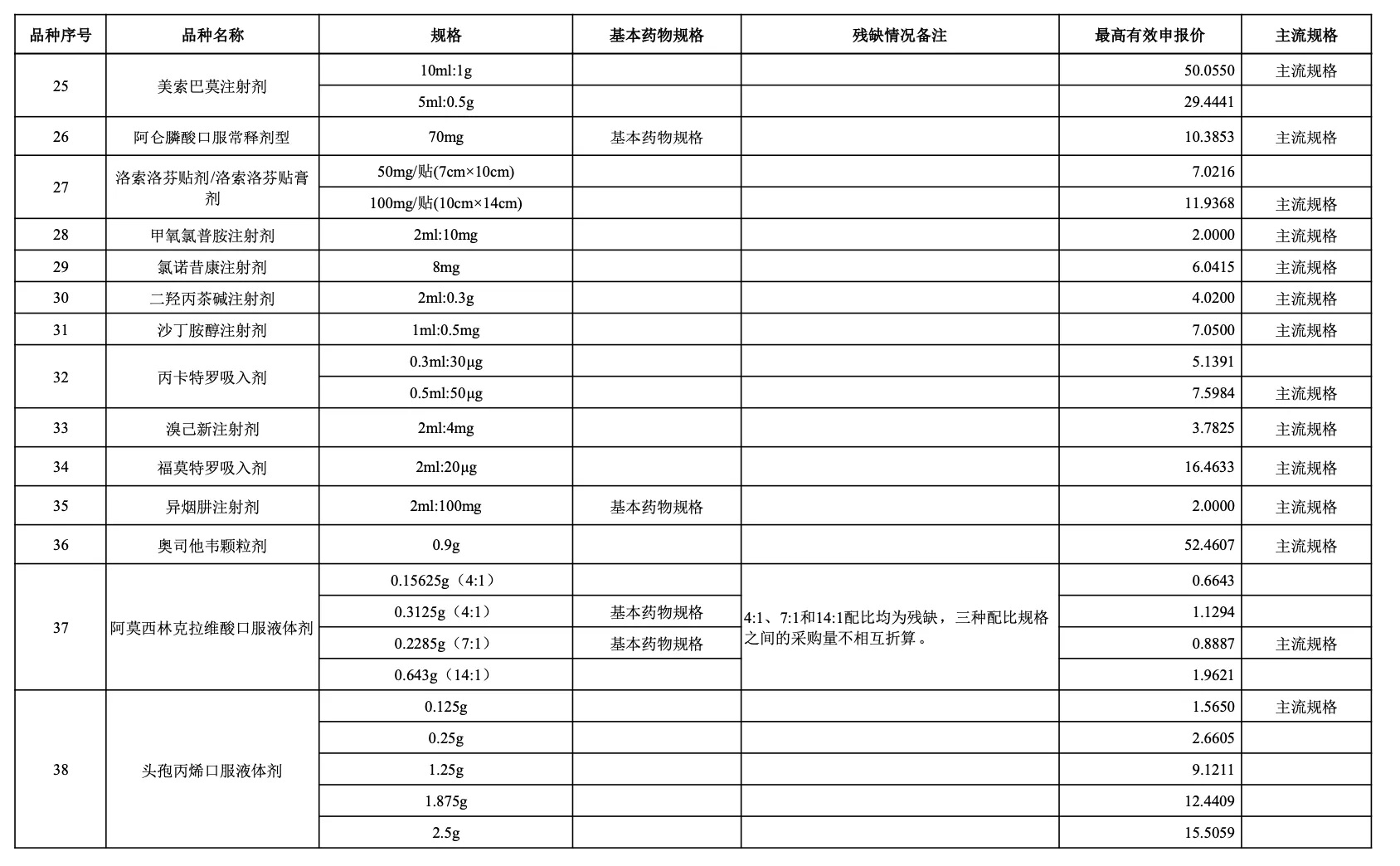
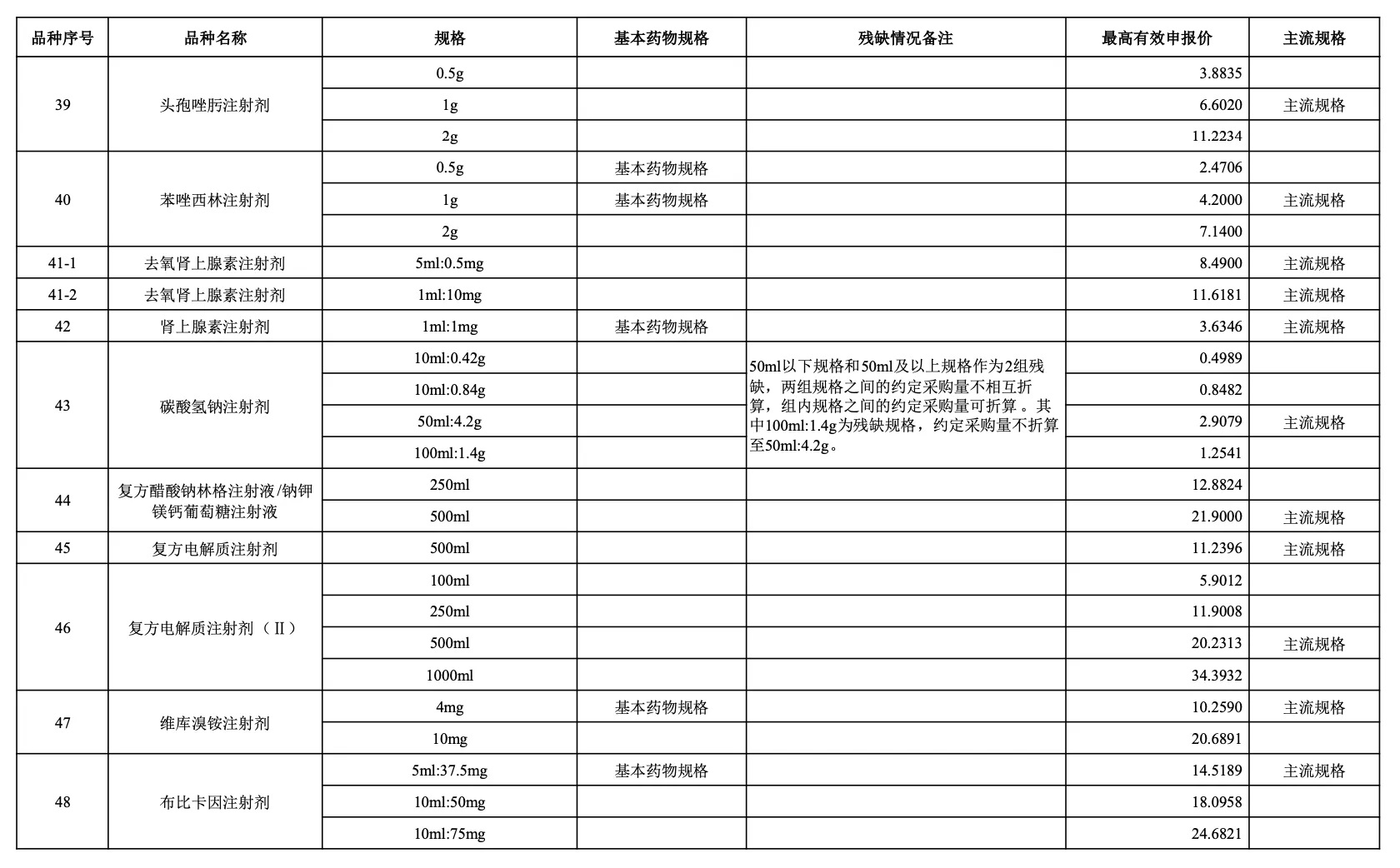
附:采購品種范圍

【來源:賽柏藍器械】

上一篇:24省耗材聯盟集采來了
下一篇:最新耗材聯盟集采來了






